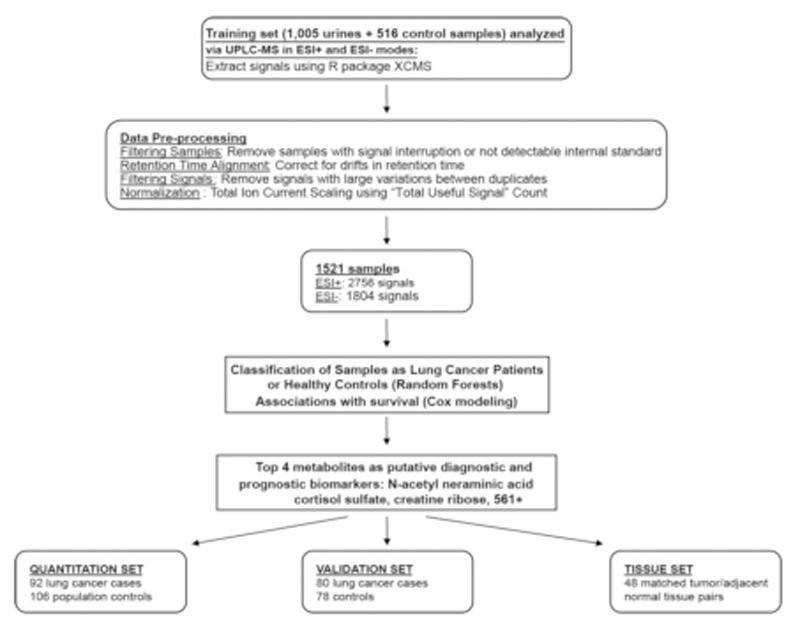
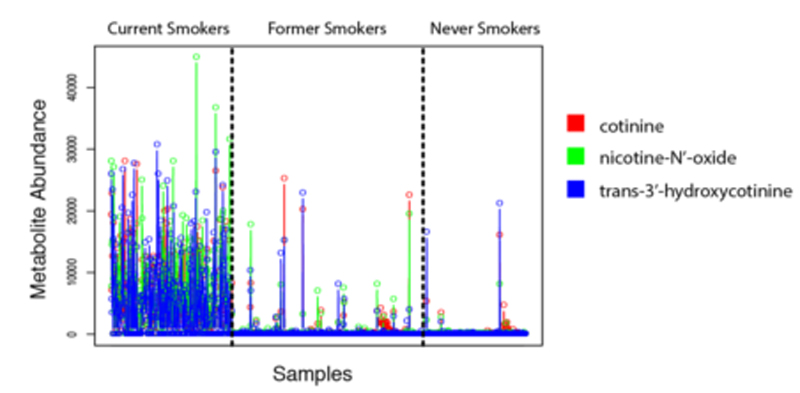
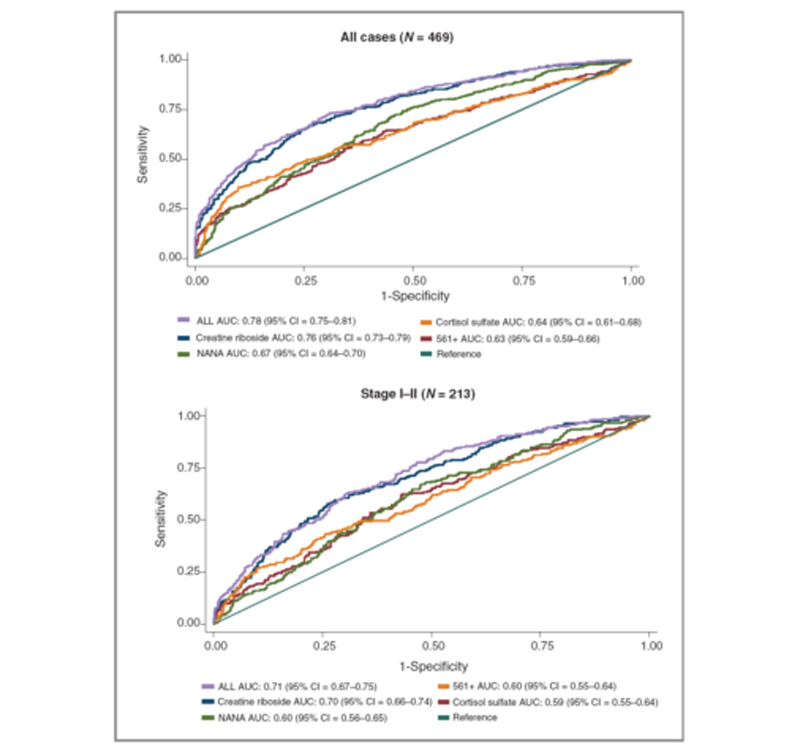
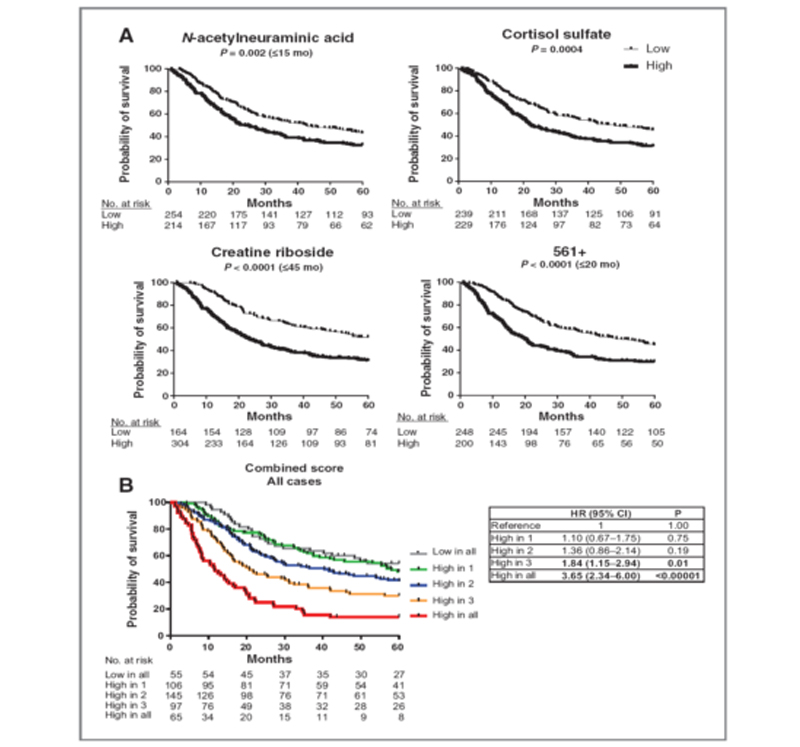
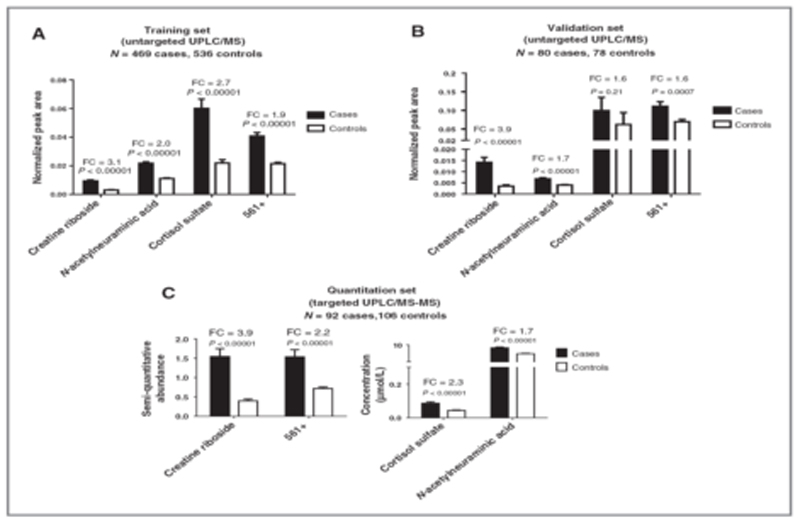
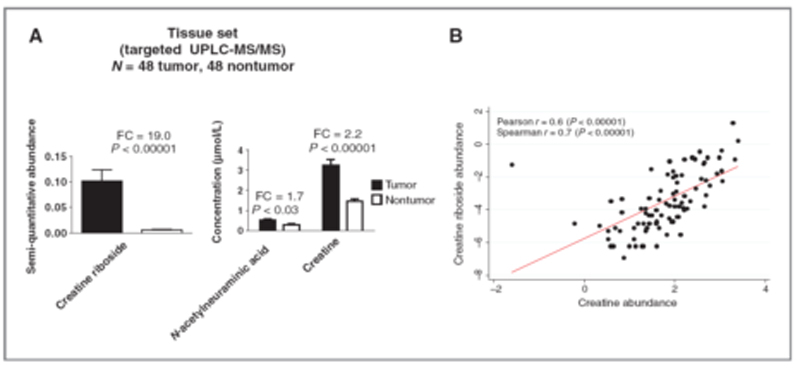
非靶向代谢组学
非靶向代谢组学(即发现代谢组学)是一种非假设方法,目的在于通过一次分析得到尽可能多的代谢物。主要是将对照组和实验组的代谢组(某一生物体的全部代谢物)进行比对,以找出其代谢物的差异,并探索差异代谢物之间的代谢通路。其分析一般包括:
a.代谢谱分析(也称为差异表达分析):在一组实验和对照样品中,寻找丰度改变有统计学意义的感兴趣代谢物。
b.鉴定:进行代谢谱分析后,测定这些代谢物的化学结构。
c.解释:研究流程的最后一步,解释所发现的代谢物与生物过程或生物状态之间的关联。
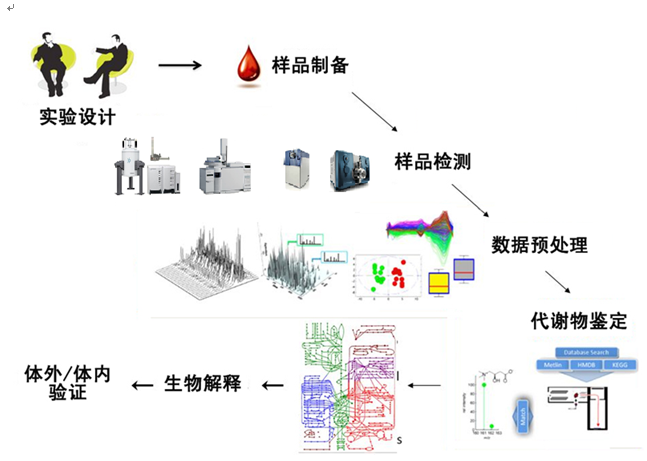
研究流程
非靶向代谢组学研究流程主要可分为实验设计、样本收集及处理、代谢物提取及浓缩、样本检测、数据分析、代谢物鉴定,最终进行生物学解释等。由于代谢组的变化极快,且代谢物种类繁多、浓度差异大、化学性质各异、数据信息庞大等因素,导致每一个步骤都可能对结果产生较大影响,实现代谢组学标准化操作至关重要。
技术平台
非靶向代谢组学检测平台主要有核磁共振(NMR)、气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS) 等分析平台,而每种平台都有一定的偏向性,研究者需要根据研究的目的、样本的类型等选择合适的分析平台,亦可以同时运用多种平台进行分析,达到更加完善、全面的研究目的。
表 非靶向代谢组学主要检测平台比较
|
主要检测平台 |
优点 |
缺点 |
|
NMR |
1、高通量 2、普适性 3、良好的客观性和重现性 4、快速(2~3 min/样) 5、预处理简单,不需要衍生化和分离 6、无损伤性 7、能检测样品中大多数有机类化合物 8、仪器使用寿命长 |
1、检测动态范围窄 2、灵敏度和分辨率较MS低 3、样品用量相对大(0.1~0.5 mL) 4、仪器和维护成本昂贵 |
|
GC-MS |
1、高通量 2、高精密度、灵敏度及重现性 3、具有可参考的标准谱图数据库,易于定性 4、样品用量适中(0.1~0.2 mL) 5、可检测样品中大多数有机和部分无机分子 |
1、需要衍生化 2、需要分离 3、分析速度较慢(20~40 min/样) 4、较难鉴定新化合物 5、不适用于难挥发性、热不稳定性物质的分析 |
|
LC-MS |
1、高通量 2、高分别率、灵敏度 3、检测动态范围宽 4、样品处理简单,不需要衍生化 5、样品用量少(10~100 μL) 6、适用于热不稳定性、不易挥发、不易衍生化和分子量较大的物质 |
1、分析速度较慢(15~40 min/样) 2、缺少可以参考的标准谱图数据库 3、较难鉴定新化合物 4、成本较高 5、仪器寿命较短 |
数据分析方法
非靶向代谢组学得到的数据是复杂的、多维的,要深度挖掘其中的信息,需要充分应用化学计量学方法。得到数据后一般先对数据进行预处理,具体过程包括归一化、数据转化、中心化、标准化等步骤。只有经过预处理,实现对数据的简化和降维,建立可靠的数据模型,应用于代谢组学数据分析的模式识别方法主要包括非监督学习方法和有监督学习方法。
非监督学习方法主要有:主成分分析法(PCA)、非线性映射、聚类分析等。有监督学习方法主要基于偏最小二乘法(PLS)、神经网络改进方法、最小二乘法-判别分析(PLS-DA)、正交最小二乘法(OPLS)等,其中PCA和PLS-DA是代谢组学常用的模式识别方法。
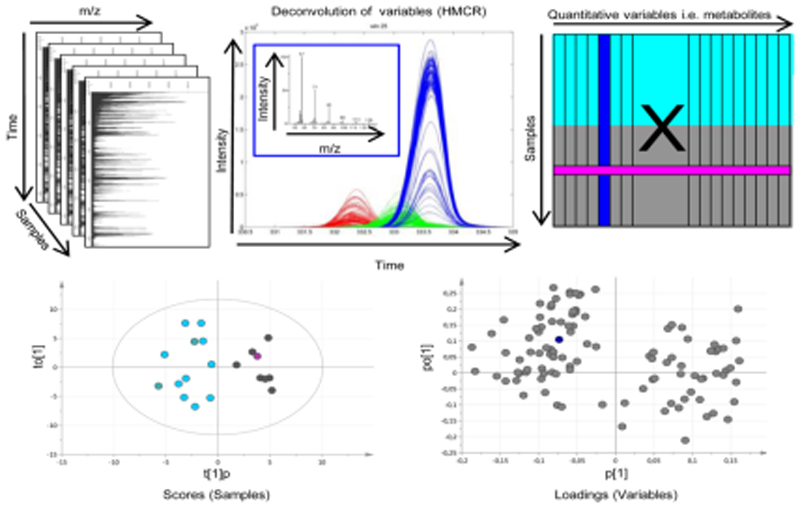
非靶向代谢组学数据处理过程
样本类型
血清 • 血浆 • 尿样 • 脑脊液 • 唾液 • 粪便 •微生物 • 细胞 • 植物 • 组织 • 其它
服务周期
武汉生物样本库公司提供的非靶向代谢组学服务和周期见下表:
|
平台 |
仪器型号 |
数据库 |
检测的化合物数目 |
检测周期 |
检测价格 |
|
GC-MS |
Aglient 7890A/5975C |
1、NIST |
数十~上百种 |
约15个工作日 |
请询价 |
|
UPLC-TOF |
SCIEX TripleTOF 5600 plus |
1、自建数据库 |
上千种 |
约20个工作日 |
请询价 |